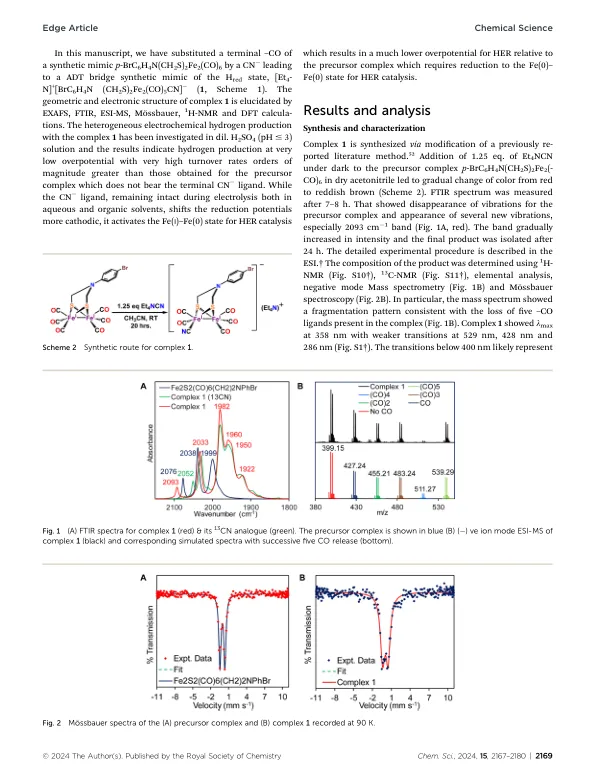
机构名称:
¥ 1.0
氢化酶(H 2 ASE)有效地将H +与H 2相互互换,其离职数(吨)(10 2 - 5 mol S -1)。1,2基于这些金属酶的活性位点存在的金属中心,三种类型的h 2 ASE在自然界中是已知的 - [Fe - Fe] H 2 ASE,[Ni - Fe] H 2 ASE和fe-fe-fe-H 2 ASE。3,4中,[Fe - Fe] H 2 ASE对H 2代的选择更具选择性,[Ni - Fe] H 2 ASE对H 2氧化是选择性的,而在氢化物受体/供体底物的前提中,仅Fe-H 2 ASE与H 2或产生H 2或产生H 2。5,6 [Fe - Fe] H 2 ASE活性位点的高分辨率X射线晶体结构表明,A Fe 2 S 2(CO)3(CO)3(CO)3(CN)2有机金属核心(2FE子站点)的一个铁中心附着于[Fe 4 s 4]通过铜氨基固醇(Schemine(Schemine 1a and B))。4,7,8键二甲基二硫代硫酸酯(ADT)部分桥梁之间的两个Fe 2 S 2 S 2(CO)3(CO)3(CN)2有机型tallic核心之间的桥梁。两个铁中心中的每个中心都与一个 - 配体和一个 - cn-配体协调。9,10 A - Co Gridges两者
简化的电催化质子减少了[fe– ...